EXCIPIENTES
Hedinger
HEDINGER EXCIPIENTES
Hedinger, fundada en 1843, fabrica y distribuye Excipientes en la Industria Farmacéutica solo bajo condiciones GMP/GDP desde sus dos plantas localizadas en Alemania (Stuttgart, donde se encuentran las oficinas centrales, y Teutschenthal, cerca de Leipzig).
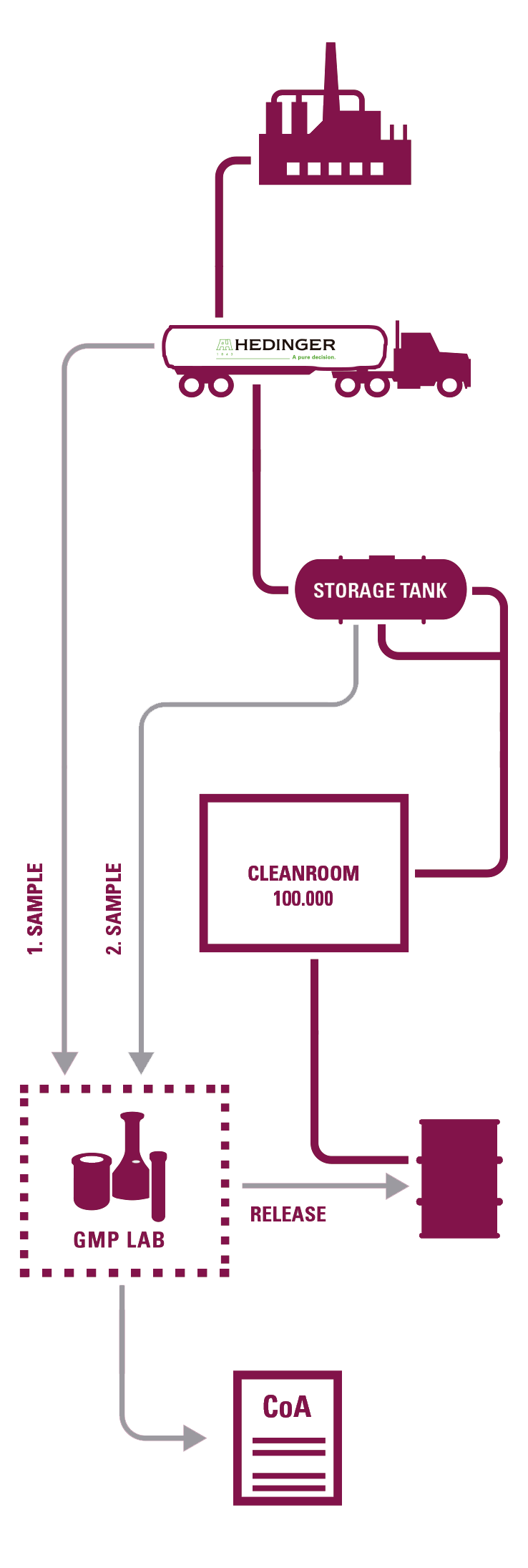
Ambas plantas están certificadas GMP por las autoridades locales alemanas y poseen 9 salas blancas (novena sala blanca en construcción) en las cuales se re- envasan todos sus Excipientes Farmacéuticos.
Desde sus 2 laboratorios GMP pueden certificar de manera general todas sus operaciones acordes a las Farmacopeas Europea, Americana y Japonesa.

Gracias a sus instalaciones de última generación, en las que por política de calidad se reinvierte anualmente en su mejora, Hedinger puede ofrecer a los clientes que fabrican especialidades más críticas (biológicos, biosimilares, inyectables) excipientes con control microbiológico y de endotoxinas sometidos a un estricto control de calidad, así como el análisis específico de
parámetros, adaptado a las necesidades del cliente. Prueba de ello es que los laboratorios fabricantes más reconocidos han depositado su confianza en la gestión de sus Excipientes.
Su catálogo de productos abarca tanto excipientes líquidos como sólidos, todos provenientes de fabricaciones globalmente reconocidos, sometidas a un proceso extra de control y / o purificación, que los diferencian de los grados técnicos y cosméticos normalmente encontrados en el mercado y por lo que son los de más alta calidad disponibles en la Industria Farmacéutica.

CUALIFICACIÓN DE PROVEEDORES
- Estándar: IPEC/PQG GMP for Pharmaceutical Excipients; ICH Q7a
- Auditorías periódicas realizadas por responsables técnicos y científicos en sus instalaciones
- Audit Reports de proveedores disponibles para consulta in situ por nuestros clientes.
TRANSPORTE EN BULK DEDICADO
- Transporte de excipientes líquidos en tanques dedicados por producto para evitar cualquier posibilidad de contaminación.
- Cualificación de tanques y equipo asociado y programa de entrenamiento de conductores.
PRIMARY PACKAGING
- Cualificación y auditorías a los fabricantes de los envases primarios (solo envases nuevos usados)
- Control de entrada y liberación del envase primario y posibilidad de trazabilidad total.
- Sistema de etiquetado cualificado
RE-ENVASADO EN SALA BLANCA
- 9 salas blancas clase 100,000 (class D)
- Cualificación acorde a EU GMP
- Control rutinario de partículas y vigilancia microbiológica
- Elevado número de personal específicamente entrenado por Hedinger (científicos, farmacéuticos, ingenieros)
ANÁLISIS Y LIBERACIÓN DE LOTES
- Análisis completo de todos los lotes acorde a GMP y COA firmado por responsable técnico
- 2 Laboratorios GMP certificados por las autoridades competentes alemanas
- Métodos implementados: Ph. Eur. / USP / JP
- Robusto proceso de control e investigación de OOS
- Cualificación de reference standards
- Liberación de lote por la Persona Cualificada (QP), según la normativa GMP
REDUCCIÓN DE ANÁLISIS DE CONTROL DE ENTRADA PARA EL FABRICANTE DE MEDICAMENTOS
Mediante acuerdo de calidad concertada con sus clientes el COA de Hedinger permite una reducción de los análisis de control de entrada de sus excipientes (EU-GMP Part 1 Chap. 5). Esta posibilidad se traduce en una reducción significativa de los costes para los clientes.
MUESTREO
- Muestreo disponible de todos nuestros productos realizado en equipo dedicado y por personal cualificado.
- Documentación acorde a GMP (SOPs, records etc.)
Retained samples de cada lote.
ESTUDIOS DE ESTABILIDAD
- Estudios de estabilidad (para casi todos los productos) acordes a ICH Q1a y en diferentes tipos de envase primario
- Estudios de estabilidad específicos y personalizados
- Reportes acordes a ICH Q1e
- Condiciones medioambientales acorde a ICH (cuando sea necesario)
- Análisis In-house de parámetros relevantes
CONFIANZA GLOBALK QUIMICA
PROVEEDOR DE CONFIANZA



