Hedinger, fundada em 1843, fabrica e distribui Excipientes para a Indústria Farmacêutica exclusivamente sob condições GMP/GDP a partir de suas duas plantas localizadas na Alemanha (Stuttgart, onde está localizada a sede, e Teutschenthal, perto de Leipzig).
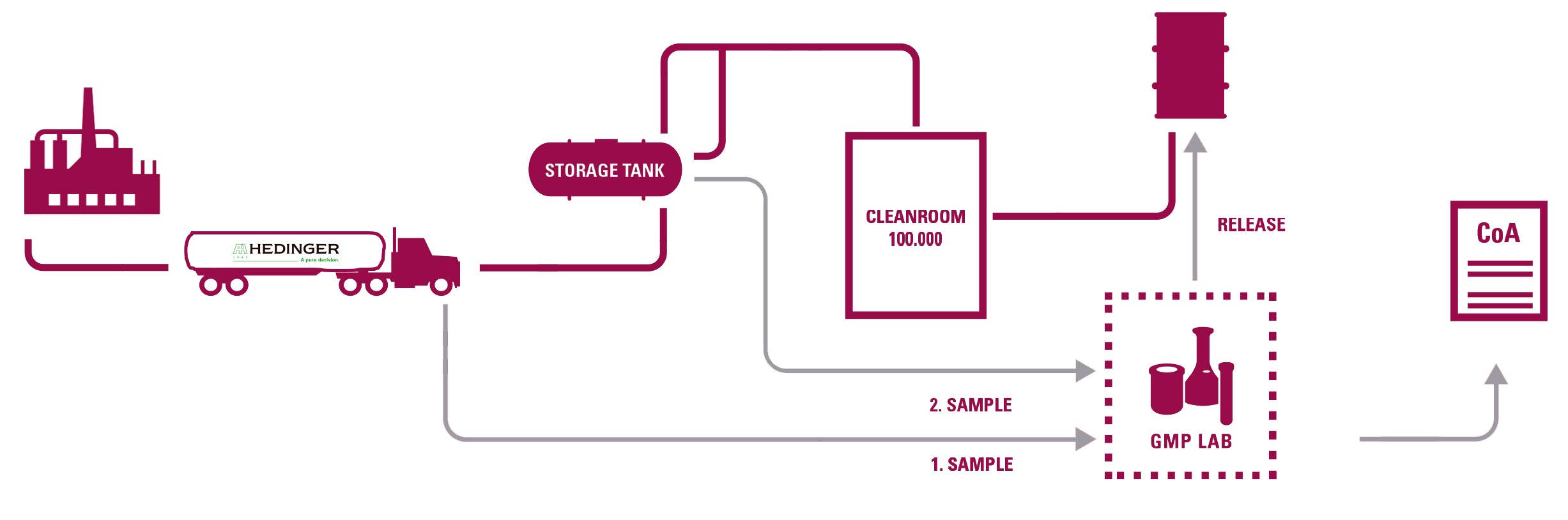
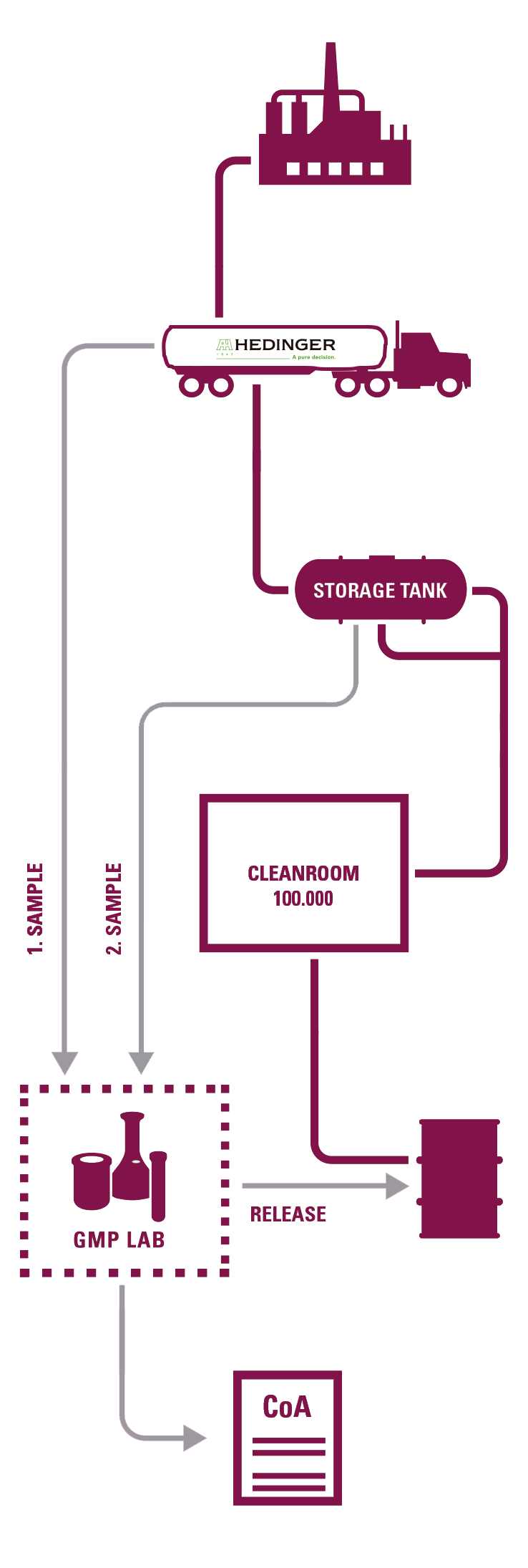
Ambas as plantas são certificadas pela GMP pelas autoridades locais alemãs e possuem 9 salas limpas nas quais todos os seus Excipientes Farmacêuticos são reembalados
A partir de seus 2 laboratórios GMP a Hedinger pode certificar de maneira geral todas as suas operações de acordo com as Farmacopeias Europeia, Americana e Japonesa.
Graças às suas instalações de última geração, nas quais a política de qualidade exige reinvestimento anual em melhorias, a Hedinger pode oferecer aos clientes que fabricam especialidades mais críticas (biológicos, biossimilares, injetáveis) excipientes com controle microbiológico e de endotoxinas sujeitos a um rigoroso controle de qualidade, bem como análise específica de parâmetros adaptados às necessidades do cliente. Prova disso é que os laboratórios fabricantes mais reconhecidos depositaram sua confiança na gestão de seus Excipientes.


O catálogo de produtos abrange tanto excipientes líquidos quanto sólidos, todos provenientes de fabricantes globalmente reconhecidos, submetidos a um processo adicional de controle e/ou purificação que os diferencia dos graus técnicos e cosméticos normalmente encontrados no mercado, tornando-os os de mais alta qualidade disponíveis na Indústria Farmacêutica.
QUALIFICAÇÃO DE FORNECEDORES
- Auditorias periódicas realizadas por pessoal técnico e científico em suas instalações.
- Relatórios de Auditoria de fornecedores disponíveis para consulta in situ por nossos clientes.
ANÁLISE E LIBERAÇÃO DE LOTES
- 2 laboratórios GMP certificados pelas autoridades competentes alemãs.
- Métodos implementados: Ph. Eur. / USP / JP..
-Processo robusto de controle e investigação de OOS.
- Qualificação de padrões de referência.
- Liberação de lote pelo Pessoa Qualificada (QP), conforme regulamentação GMP.
EMBALAGEM PRIMÁRIA
- Controle de entrada e liberação da embalagem primária e possibilidade de rastreabilidade total.
- Sistema de etiquetagem qualificado
AMOSTRAGEM
-Documentação de acordo com GMP (SOPs, registros, etc.). Amostras retidas de cada lote.
TRANSPORTE A GRANEL DEDICADO
- Qualificação de tanques e equipamentos associados e programa de treinamento de motoristas.
REENVASAMENTO EM SALA LIMPA
- Qualificação de acordo com a GMP da UE.
- Controle rotineiro de partículas e monitoramento microbiológico.
- Grande número de pessoal especificamente treinado pela Hedinger (cientistas, farmacêuticos, engenheiros).
REDUÇÃO DA ANÁLISE DE CONTROLE DE ENTRADA PARA O FABRICANTE DE MEDICAMENTOS
ESTUDOS DE ESTABILIDADE
- Estudos de estabilidade específicos e personalizados.
- Relatórios de acordo com ICH Q1e
- Condições ambientais de acordo com ICH (quando necessário).
- Análise interna de parâmetros relevantes.